Un gas ideal es una representación teórica de un conjunto de partículas que se mueven de forma puntual y aleatoria, sin interactuar entre sí. Este concepto resulta fundamental porque los gases ideales siguen la ley de los gases ideales, una ecuación de estado simplificada que se analiza a través de la mecánica estadística.
En condiciones normales, como las que corresponden a la presión y temperatura habituales, la mayoría de los gases reales exhiben un comportamiento cualitativamente similar al de un gas ideal. Por lo general, la desviación del comportamiento ideal es más evidente a temperaturas más bajas o a presiones más elevadas, donde las fuerzas intermoleculares adquieren mayor relevancia. Esto se debe a que, en tales condiciones, el trabajo ejercido por estas fuerzas es más significativo en comparación con la energía cinética de las partículas, y el tamaño de las moléculas resulta más crítico en relación con el espacio vacío entre ellas.
Sin embargo, el modelo del gas ideal tiende a no ser preciso a temperaturas muy bajas o a presiones elevadas, donde las fuerzas intermoleculares y el tamaño de las moléculas desempeñan un papel crucial. Además, por lo general, no es adecuado para gases más densos, como el vapor de agua o muchos fluidos refrigerantes. En condiciones de temperaturas bajas y presiones elevadas, los gases reales pueden experimentar una transición de fase hacia un estado líquido o sólido, un fenómeno que el modelo del gas ideal no puede describir ni permitir. En estos casos, se requieren ecuaciones de estado más complejas para modelar estos comportamientos.
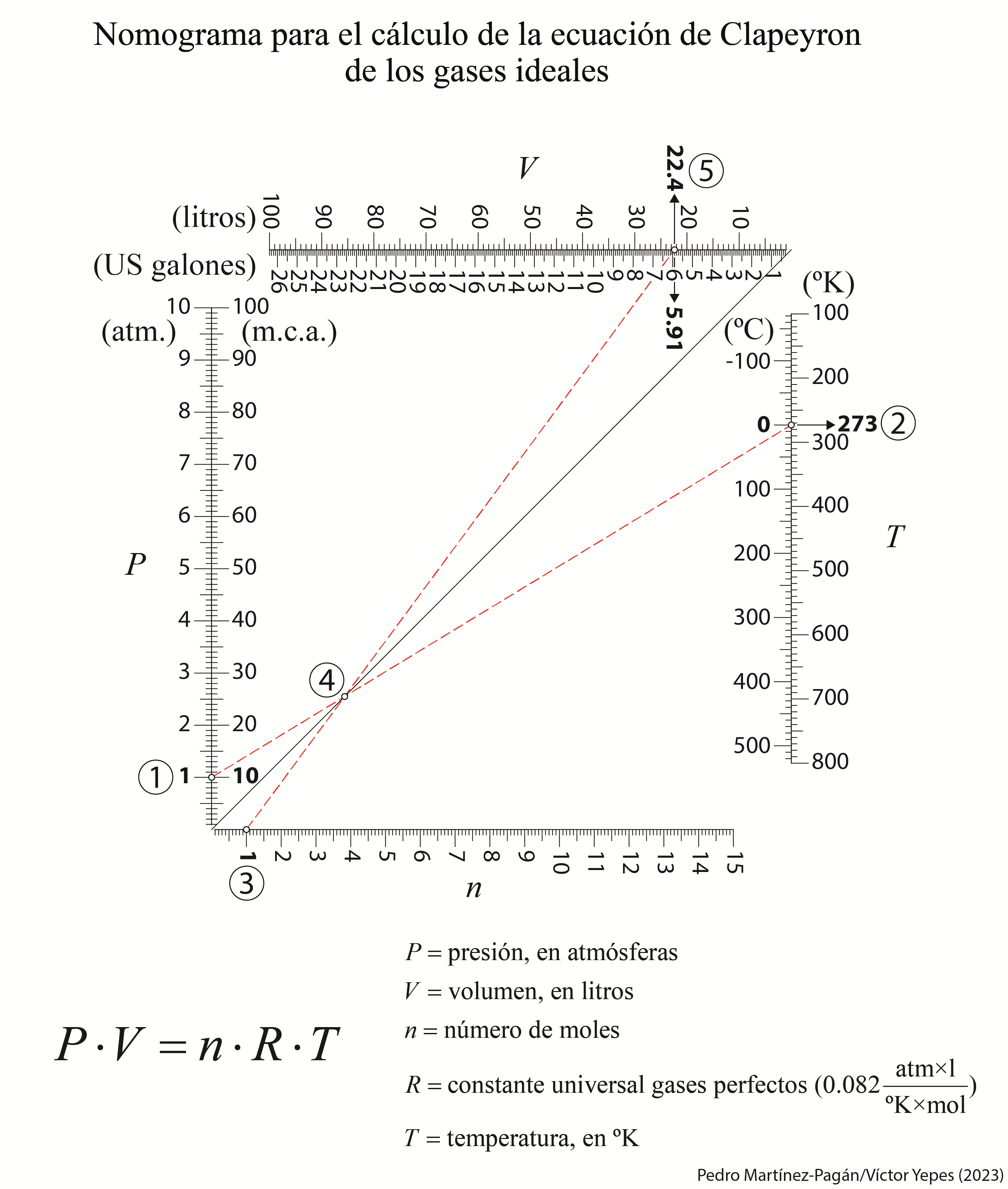
La ecuación que vincula las variables P, V y T para una cantidad específica de gas se conoce como la ecuación de estado. Para ilustrar, si tenemos información sobre la presión y el volumen, podemos determinar la temperatura mediante la ecuación de estado. En el caso de un gas ideal, la ecuación de estado específica es P·V=n·R·T. El concepto de gas ideal representa una extrapolación del comportamiento de los gases reales en condiciones de baja densidad y presión hacia un comportamiento ideal. No obstante, para densidades y presiones más elevadas, es necesario aplicar ciertas correcciones a esta ecuación para que sea aplicable a gases reales.
A continuación os dejo un nomograma elaborado en colaboración con el profesor Pedro Martínez Pagán, de la Universidad Politécnica de Cartagena, donde se puede calcular gráficamente la ecuación de estado para un gas ideal. En este caso, se ha calculado el volumen de un mol de un gas ideal a 1 atmósfera y 0 °C, que es de 22,4 litros. Espero que os sea de interés.
Aquí tienes un par de vídeos explicativos que, espero, sea de tu interés.
Referencias:
YEPES, V.; MARTÍ, J.V. (2017). Máquinas, cables y grúas empleados en la construcción. Editorial de la Universitat Politècnica de València. Ref. 814. Valencia, 210 pp.
YEPES, V. (2023). Maquinaria y procedimientos de construcción. Problemas resueltos. Colección Académica. Editorial Universitat Politècnica de València, 562 pp. Ref. 376. ISBN 978-84-1396-174-3

Esta obra está bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.